
3 月 6 日,美国制药公司默沙东及辉瑞称美国 FDA 已经接受了公司用于控制成人 2 型糖尿病患者血糖水平的 SGLT2 抑制剂 ertugliflozin 及其复方的新药上市申请,其中复方产品为 ertugliflozin 联合 JANUVIA? (西他列汀) 的固定剂量复方及 ertugliflozin 联合二甲双胍的固定剂量复方,本次上市申请的 PDUFA 日期为 2017 年 12 月份。
另外,欧洲药品监管机构 EMA 同样也已经接受了 ertugliflozin 单药及其另两种复方药物的上市申请。
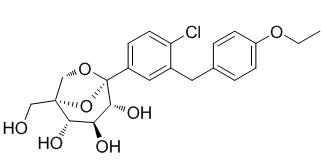
默沙东及辉瑞在美国及欧洲地区提交的上市申请,是基于 ertugliflozin 的 VERTIS 临床研究项目,该临床研究包括 VERTIS MONO,VERTIS FACTORIAL 和 VERTIS SITA2,相关研究信息已经在 2016 年的医学会议上首次报道。整个 VERTIS 临床项目共包括 9 项临床 3 期试验,大概共 12600 名成人 2 型糖尿病患者入组该研究。
默沙东公司糖尿病和内分泌临床开发部门助理副总裁 Sam Engel 博士表示:“这次 FDA 及 EMA 对 ertugliflozin 及其复方共 3 个药物的新药上市申请的接受,是我们公司与辉瑞制药在 ertugliflozin 开发历程中的里程碑事件,同时彰显了我们公司致力于为全世界的 2 型糖尿病患者提供新的治疗药物选择的决心。” “我们相信,该药物一旦获得批准,将会受到 2 型糖尿病患者的欢迎并会进一步增强我们以 DPP- 4 抑制剂 JANUVIA(sitagliptin- 西他列汀)为引领的的 2 型糖尿病管线实力。”
辉瑞公司负责全球产品开发的心血管和代谢疾病首席开发官 James Rusnak 博士同样表示:“由于 2 型糖尿病属于慢性进展性疾病,在整个治疗过程中,患者可能需要多种可选择药物去进行自我疾病的控制,我们的临床研究项目 VERTIS 在这方面已经做了广泛的临床研究。同时,我们一定会同 FDA 及 EMA 的审评官员保持紧密联系以让 2 型糖尿病患者更顺利的获得这三种治疗药物。(生物谷 Bioon.com)

